FY/25 Annual Press Conference


Geschäftsjahr 2025: starker Anstieg beim organischen Umsatz und exzellentes Wachstum beim Ergebnis je Aktie; REJUVENATE in Action: #Future Fresenius Strategiephase treibt profitables Wachstum und sorgt für eine robuste Bilanz.
4. Quartal 2025: Starker Jahresabschluss mit ausgezeichnetem organischen Umsatz- und EBIT-Wachstum; sehr gute operative Cashflow-Entwicklung.
Michael Sen, Vorstandsvorsitzender von Fresenius: „2025 war ein entscheidendes Jahr für Fresenius. Dank der disziplinierten Umsetzung unserer #FutureFresenius-Strategie und einer starken Team-Leistung haben wir unsere erhöhte Prognose erreicht und konnten das Jahr mit einem weiteren hervorragenden Quartal abschließen. Im vierten Quartal stieg unser Umsatz organisch um 9 Prozent, das EBIT-Wachstum lag währungsbereinigt bei 13 Prozent und das Kern-Ergebnis je Aktie erhöhte sich währungsbereinigt um 16 Prozent. 2025 haben wir unser Momentum kontinuierlich gesteigert: Wir haben unsere Bilanz weiter gestärkt und unseren Ausblick angehoben. Gleichzeitig haben wir zielgerichtet investiert, um unsere Geschäfte auf die nächste Wachstumsphase vorzubereiten. Für das Geschäftsjahr 2025 schlagen wir deshalb eine Erhöhung der Dividende auf 1,05 Euro je Aktie vor. Damit unterstreichen wir unseren Anspruch, unsere Aktionäre an der Wertsteigerung des Unternehmens zu beteiligen. Mit #FutureFresenius haben wir unser Unternehmen grundlegend erneuert. Wir sind heute so positioniert, dass wir auch in einer neuen Weltordnung erfolgreich sein können. In das Jahr 2026 gehen wir gestärkt und mit klaren Prioritäten. Wir sind überzeugt, dass wir auch weiterhin profitabel und nachhaltig wachsen werden, mit einem organischen Umsatzwachstum von 4 bis 7 Prozent und einem währungsbereinigten Wachstum beim Kern-Ergebnis je Aktie von 5 bis 10 Prozent. Dabei haben wir unser Ziel fest im Blick, langfristig Wert im Gesundheitsökosystem zu schaffen – für unsere Patientinnen und Patienten, Kunden, Partner und Aktionäre.“
Fresenius-Konzern6: organisches Umsatzwachstum2 von 4 bis 7 %; währungsbereinigtes Wachstum beim Kern-Ergebnis je Aktie1 von 5 bis 10 %; EBIT-Marge9 bei ~11,5 %.
Fresenius Kabi7: organisches Umsatzwachstum3 im mittleren bis hohen einstelligen Prozentbereich; EBIT-Marge1 von 16,5 bis 17,0 %.
Strukturelle EBIT-Margen1-Ambition erhöht auf 17 bis 19 % (zuvor 16 bis 18 %) nach der konsequenten und disziplinierten Umsetzung der Strategie, die in den vergangenen Jahren zu einer kontinuierlichen Margenausweitung geführt hat.
Fresenius Helios8: organisches Umsatzwachstum im mittleren einstelligen Prozentbereich; EBIT-Marge von 10,0 bis 10,5 %.
Prämissen für den Ausblick: Der Ausblick berücksichtigt anhaltende Trends eines sich schnell verändernden makroökonomischen und geopolitischen Umfelds, das zu einem höheren Maß an Volatilität und operativer Unsicherheit führt. Der Ausblick berücksichtigt keine möglichen Extremszenarien, die sich aus dem dynamischen geopolitischen und makro- ökonomischen Umfeld ergeben könnten. Mögliche Auswirkungen des Urteils des Obersten Gerichtshofs der Vereinigten Staaten vom 20. Februar 2026 werden derzeit geprüft, können jedoch zum jetzigen Zeitpunkt nicht vollständig abgeschätzt werden und sind daher in den Prognosen für das Geschäftsjahr 2026 nicht berücksichtigt.
Fresenius wird seinen Aktionärinnen und Aktionären auch weiterhin attraktive Renditen sichern. Das Unternehmen wird für das Geschäftsjahr 2025 eine Dividende von 1,05 € je Aktie vorschlagen. Das entspricht einer Ausschüttungsquote von 37 % und liegt damit in der oberen Hälfte des im Fresenius Financial Framework festgelegten Rahmens von 30 bis 40 % des Konzernergebnisses1 ohne FMC (Kern- Ergebnis1).
Geschäftsjahr 2025 trotz signifikanter makroökonomischer Einflüsse mit starker Performance beendet, zwei Mal nach oben korrigierte Jahresprognose erreicht.
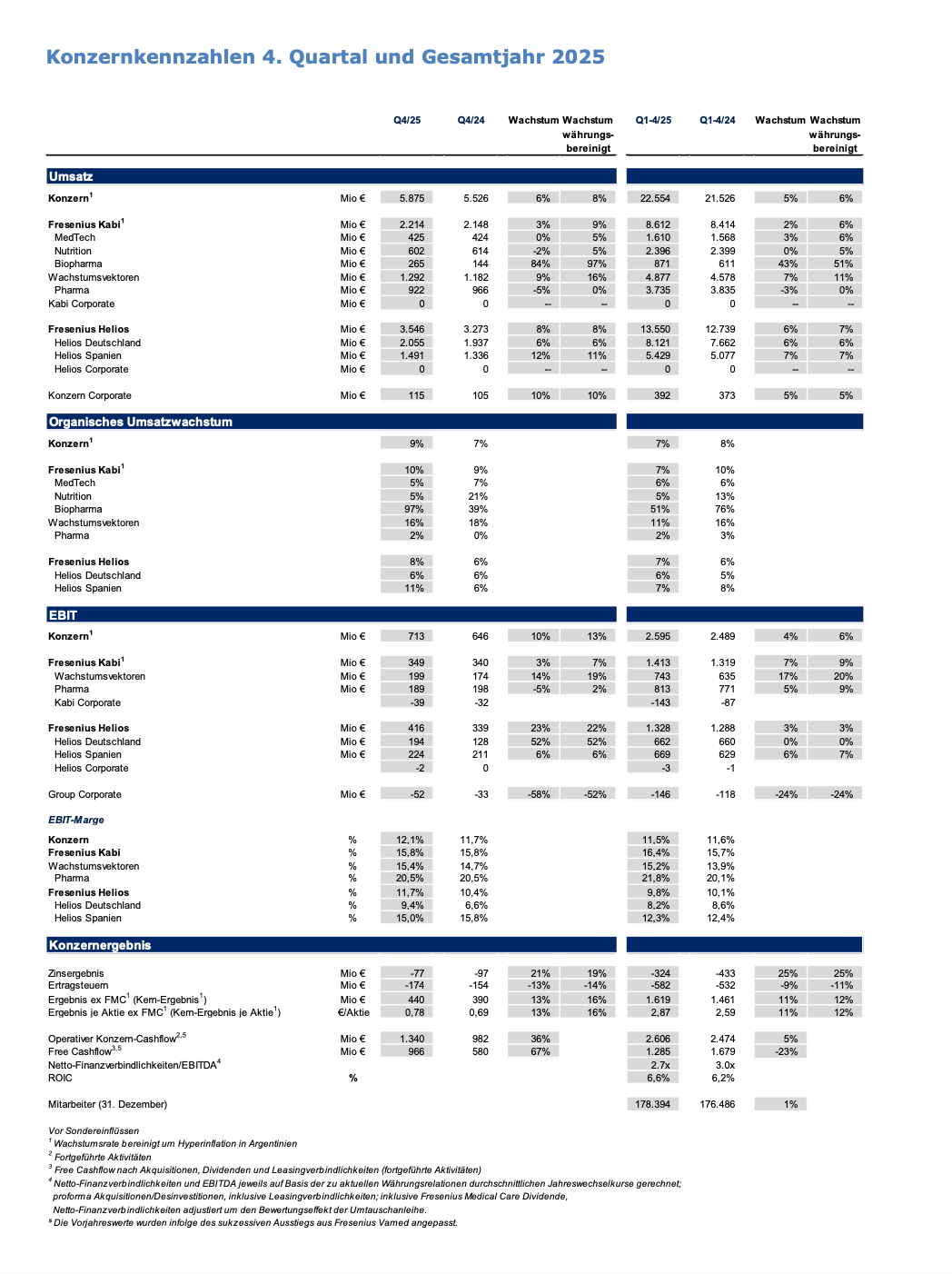
Die gute Geschäftsentwicklung führte zu einem Anstieg des organischen Konzernumsatzes1 um 7%2 , der damit das obere Ende des Ausblicks von 5 bis 7 % erreichte. Das Wachstum des währungsbereinigten Konzern-EBIT vor Sondereinflüssen lag mit 6 %3 voll im Rahmen des Ausblicks von 4 bis 8 %. Dies erreichte das Unternehmen trotz erheblicher gegenläufiger Effekte, darunter die beendeten Energiekostenhilfen bei Fresenius Helios, die Belastungen aus dem Tendergeschäft in China im Zusammenhang mit dem Produkt Ketosteril bei Fresenius Kabi sowie Wechselkurseffekte und US-Zölle.
Ausgezeichnetes 4. Quartal 2025 schließt das Gesamtjahr 2025 mit einem Anstieg von 9 %2 beim organischen Konzern-Umsatz1 auf 5.875 Mio € ab.
Das Wachstum des währungsbereinigten Konzern-EBIT vor Sondereinflüssen erreichte ein Plus von 13 %3 auf 713 Mio € und beschleunigte sich damit deutlich. Der Anstieg war auf die kontinuierlich starke Entwicklung bei Fresenius Kabi sowie die erwartete starke Entwicklung bei Fresenius Helios zurückzuführen. Die Beschleunigung bei Fresenius Helios wurde getrieben von der sehr starken Umsatzentwicklung und den Einsparungen aus der Umsetzung des Performance- Programms sowie positiven Effekten des Rechnungszuschlags für gesetzlich versicherte Patientinnen und Patienten, der unter sonstigen betrieblichen Erträgen erfasst wird. Bei Fresenius Kabi trugen insbesondere die gute Umsatzentwicklung und weitere Kosteneffizienzsteigerungen zur Entwicklung bei. Die gegenläufig wirkenden Belastungen aus dem Tendergeschäft in China im Zusammenhang mit dem Produkt Ketosteril sowie gezielte Investitionen konnten damit mehr als kompensiert werden.
Die Konzern EBIT-Marge1 verbesserte sich um 40 Basispunkte auf 12,1 %.
Das Konzernergebnis1 ohne FMC (Kern-Ergebnis1) stieg währungsbereinigt um 16 %3 auf 440 Mio € und damit deutlich überproportional zum Umsatz. Gründe dafür waren die gute operative Entwicklung der beiden Kerngeschäfte, weitere Produktivitätssteigerungen sowie die deutlich gesunkenen Zinsaufwendungen.
Das währungsbereinigte Kern-Ergebnis je Aktie1 stieg um 16 %3 auf 0,78 €.
Fresenius Kabi
Fresenius Kabi entwickelte sich über das Geschäftsjahr 2025 hinweg konstant stark mit einem ausgezeichneten organischen Umsatzwachstum von 7 % am oberen Ende des strukturellen Wachstumsbands. Die EBIT- Marge verbesserte sich um 70 Basispunkte auf 16,4 %.
Der starke Jahresendspurt im 4. Quartal 2025 führte zu einer organischen Umsatzsteigerung deutlich oberhalb des strukturellen Wachstumsbands, vor allem aufgrund der Wachstumsvektoren, die angeführt waren von Biopharma. Die EBIT-Marge war beeinflusst von gezielten Investitionen, sowie Jahresendeffekte.
Das organische Umsatzwachstum von 10 %2 im 4. Quartal war getragen von den Wachstumsvektoren, insbesondere von Biopharma dank erfolgreicher Ausweitung der Produkteinführungen. Der Umsatz erreichte mit 2.214 Mio € den höchsten absoluten Wert in einem Einzelquartal in der Fresenius Kabi-Unternehmensgeschichte; Währungsumrechnungseffekte, im Wesentlichen aus dem US-Dollar und dem argentinischen Peso, beeinflussten das berichtete Wachstum deutlich negativ.
Fresenius Helios
Im Geschäftsjahr 2025 erzielte Fresenius Helios aufgrund eines soliden Fallzahlenwachstums und positiver Preisentwicklung in Deutschland und Spanien ein organisches Umsatzwachstum von 7 %. Die EBIT-Marge lag mit 9,8 %1 im Rahmen des Ausblicks für das Geschäftsjahr 2025.
Im 4. Quartal 2025 verzeichnete Fresenius Helios ein sehr starkes organisches Umsatzwachstum und eine ausgezeichnete Margenverbesserung.
Das organische Umsatzwachstum lag bei 8 % bedingt durch die gestiegene Anzahl durchgeführter Behandlungen in Deutschland und Spanien sowie die positive Preisentwicklung; Umsatzanstieg währungsbereinigt um 8 % auf 3.546 Mio €.
1 Vor Sondereinflüssen
2 Organische Wachstumsrate bereinigt um Rechnungslegungseffekte im Zusammenhang mit der Hyperinflation in Argentinien
3 Wachstumsrate bereinigt um Hyperinflation in Argentinien
4 Ohne Fresenius Medical Care
5 Netto-Finanzverbindlichkeiten und EBITDA jeweils auf Basis der zu aktuellen Währungsrelationen durchschnittlichen Jahreswechselkurse gerechnet; proforma Akquisitionen/Desinvestitionen, inklusive Leasingverbindlichkeiten; inklusive Fresenius Medical Care Dividende, Netto-Finanzverbindlichkeiten adjustiert um den Bewertungseffekt der Umtauschanleihe
6 2025 Basis: 22.554 Mio € (Umsatz) und 2,87 € (Core Ergebnis je Aktie1,4)
7 2025 Basis: 8.612 Mio € (Umsatz) und 1.413 Mio € (EBIT)
8 2025 Basis: 13.550 Mio € (Umsatz) und 1.328 Mio € (EBIT)
9 Diese Kennzahl (EBIT-Marge) wird ausschließlich nachrichtlich bzw. zu Modellierungszwecken bereitgestellt Sie ist nicht Bestandteil des offiziellen Ausblicks; 2025 Basis: 2.595 Mio €
Telefonkonferenz und Audio-Webcast
Anlässlich der Veröffentlichung der Ergebnisse für das 4. Quartal und Geschäftsjahr 2025 findet am 25. Februar 2026 um 13:30 Uhr MEZ / 07:30 Uhr EST eine Telefonkonferenz bzw. ein Audio-Webcast statt. Die Telefonkonferenz können Sie live über das Internet verfolgen unter www.fresenius.de/investoren. Nach der Veranstaltung steht Ihnen die Aufzeichnung zur Verfügung.

Hinweis auf Darstellungsweise der Finanzzahlen
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zurzeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts- und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren, die Verfügbarkeit finanzieller Mittel sowie unvorhergesehene Auswirkungen internationaler Konflikte. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Fresenius SE & Co. KGaA Sitz der Gesellschaft: Bad Homburg, Deutschland / Handelsregister: Amtsgericht Bad Homburg, HRB 11852
Aufsichtsratsvorsitzender: Wolfgang Kirsch
Persönlich haftende Gesellschafterin: Fresenius Management SE Sitz der Gesellschaft: Bad Homburg, Deutschland / Handelsregister: Amtsgericht Bad Homburg, HRB 11673 Vorstand: Michael Sen (Vorsitzender), Pierluigi Antonelli, Sara Hennicken, Robert Möller, Dr. Michael Moser
Aufsichtsratsvorsitzender: Wolfgang Kirsch
Conference Call FY/2025 Präsentation
Geschäftsjahr 2025: starker Anstieg beim organischen Umsatz und exzellentes Wachstum beim Ergebnis je Aktie; REJUVENATE in Action: #Future Fresenius Strategiephase treibt profitables Wachstum und sorgt für eine robuste Bilanz.
4. Quartal 2025: Starker Jahresabschluss mit ausgezeichnetem organischen Umsatz- und EBIT-Wachstum; sehr gute operative Cashflow-Entwicklung.
Michael Sen, Vorstandsvorsitzender von Fresenius: „2025 war ein entscheidendes Jahr für Fresenius. Dank der disziplinierten Umsetzung unserer #FutureFresenius-Strategie und einer starken Team-Leistung haben wir unsere erhöhte Prognose erreicht und konnten das Jahr mit einem weiteren hervorragenden Quartal abschließen. Im vierten Quartal stieg unser Umsatz organisch um 9 Prozent, das EBIT-Wachstum lag währungsbereinigt bei 13 Prozent und das Kern-Ergebnis je Aktie erhöhte sich währungsbereinigt um 16 Prozent. 2025 haben wir unser Momentum kontinuierlich gesteigert: Wir haben unsere Bilanz weiter gestärkt und unseren Ausblick angehoben. Gleichzeitig haben wir zielgerichtet investiert, um unsere Geschäfte auf die nächste Wachstumsphase vorzubereiten. Für das Geschäftsjahr 2025 schlagen wir deshalb eine Erhöhung der Dividende auf 1,05 Euro je Aktie vor. Damit unterstreichen wir unseren Anspruch, unsere Aktionäre an der Wertsteigerung des Unternehmens zu beteiligen. Mit #FutureFresenius haben wir unser Unternehmen grundlegend erneuert. Wir sind heute so positioniert, dass wir auch in einer neuen Weltordnung erfolgreich sein können. In das Jahr 2026 gehen wir gestärkt und mit klaren Prioritäten. Wir sind überzeugt, dass wir auch weiterhin profitabel und nachhaltig wachsen werden, mit einem organischen Umsatzwachstum von 4 bis 7 Prozent und einem währungsbereinigten Wachstum beim Kern-Ergebnis je Aktie von 5 bis 10 Prozent. Dabei haben wir unser Ziel fest im Blick, langfristig Wert im Gesundheitsökosystem zu schaffen – für unsere Patientinnen und Patienten, Kunden, Partner und Aktionäre.“
Fresenius-Konzern6: organisches Umsatzwachstum2 von 4 bis 7 %; währungsbereinigtes Wachstum beim Kern-Ergebnis je Aktie1 von 5 bis 10 %; EBIT-Marge9 bei ~11,5 %.
Fresenius Kabi7: organisches Umsatzwachstum3 im mittleren bis hohen einstelligen Prozentbereich; EBIT-Marge1 von 16,5 bis 17,0 %.
Strukturelle EBIT-Margen1-Ambition erhöht auf 17 bis 19 % (zuvor 16 bis 18 %) nach der konsequenten und disziplinierten Umsetzung der Strategie, die in den vergangenen Jahren zu einer kontinuierlichen Margenausweitung geführt hat.
Fresenius Helios8: organisches Umsatzwachstum im mittleren einstelligen Prozentbereich; EBIT-Marge von 10,0 bis 10,5 %.
Prämissen für den Ausblick: Der Ausblick berücksichtigt anhaltende Trends eines sich schnell verändernden makroökonomischen und geopolitischen Umfelds, das zu einem höheren Maß an Volatilität und operativer Unsicherheit führt. Der Ausblick berücksichtigt keine möglichen Extremszenarien, die sich aus dem dynamischen geopolitischen und makro- ökonomischen Umfeld ergeben könnten. Mögliche Auswirkungen des Urteils des Obersten Gerichtshofs der Vereinigten Staaten vom 20. Februar 2026 werden derzeit geprüft, können jedoch zum jetzigen Zeitpunkt nicht vollständig abgeschätzt werden und sind daher in den Prognosen für das Geschäftsjahr 2026 nicht berücksichtigt.
Fresenius wird seinen Aktionärinnen und Aktionären auch weiterhin attraktive Renditen sichern. Das Unternehmen wird für das Geschäftsjahr 2025 eine Dividende von 1,05 € je Aktie vorschlagen. Das entspricht einer Ausschüttungsquote von 37 % und liegt damit in der oberen Hälfte des im Fresenius Financial Framework festgelegten Rahmens von 30 bis 40 % des Konzernergebnisses1 ohne FMC (Kern- Ergebnis1).
Geschäftsjahr 2025 trotz signifikanter makroökonomischer Einflüsse mit starker Performance beendet, zwei Mal nach oben korrigierte Jahresprognose erreicht.
Die gute Geschäftsentwicklung führte zu einem Anstieg des organischen Konzernumsatzes1 um 7%2 , der damit das obere Ende des Ausblicks von 5 bis 7 % erreichte. Das Wachstum des währungsbereinigten Konzern-EBIT vor Sondereinflüssen lag mit 6 %3 voll im Rahmen des Ausblicks von 4 bis 8 %. Dies erreichte das Unternehmen trotz erheblicher gegenläufiger Effekte, darunter die beendeten Energiekostenhilfen bei Fresenius Helios, die Belastungen aus dem Tendergeschäft in China im Zusammenhang mit dem Produkt Ketosteril bei Fresenius Kabi sowie Wechselkurseffekte und US-Zölle.
Ausgezeichnetes 4. Quartal 2025 schließt das Gesamtjahr 2025 mit einem Anstieg von 9 %2 beim organischen Konzern-Umsatz1 auf 5.875 Mio € ab.
Das Wachstum des währungsbereinigten Konzern-EBIT vor Sondereinflüssen erreichte ein Plus von 13 %3 auf 713 Mio € und beschleunigte sich damit deutlich. Der Anstieg war auf die kontinuierlich starke Entwicklung bei Fresenius Kabi sowie die erwartete starke Entwicklung bei Fresenius Helios zurückzuführen. Die Beschleunigung bei Fresenius Helios wurde getrieben von der sehr starken Umsatzentwicklung und den Einsparungen aus der Umsetzung des Performance- Programms sowie positiven Effekten des Rechnungszuschlags für gesetzlich versicherte Patientinnen und Patienten, der unter sonstigen betrieblichen Erträgen erfasst wird. Bei Fresenius Kabi trugen insbesondere die gute Umsatzentwicklung und weitere Kosteneffizienzsteigerungen zur Entwicklung bei. Die gegenläufig wirkenden Belastungen aus dem Tendergeschäft in China im Zusammenhang mit dem Produkt Ketosteril sowie gezielte Investitionen konnten damit mehr als kompensiert werden.
Die Konzern EBIT-Marge1 verbesserte sich um 40 Basispunkte auf 12,1 %.
Das Konzernergebnis1 ohne FMC (Kern-Ergebnis1) stieg währungsbereinigt um 16 %3 auf 440 Mio € und damit deutlich überproportional zum Umsatz. Gründe dafür waren die gute operative Entwicklung der beiden Kerngeschäfte, weitere Produktivitätssteigerungen sowie die deutlich gesunkenen Zinsaufwendungen.
Das währungsbereinigte Kern-Ergebnis je Aktie1 stieg um 16 %3 auf 0,78 €.
Fresenius Kabi
Fresenius Kabi entwickelte sich über das Geschäftsjahr 2025 hinweg konstant stark mit einem ausgezeichneten organischen Umsatzwachstum von 7 % am oberen Ende des strukturellen Wachstumsbands. Die EBIT- Marge verbesserte sich um 70 Basispunkte auf 16,4 %.
Der starke Jahresendspurt im 4. Quartal 2025 führte zu einer organischen Umsatzsteigerung deutlich oberhalb des strukturellen Wachstumsbands, vor allem aufgrund der Wachstumsvektoren, die angeführt waren von Biopharma. Die EBIT-Marge war beeinflusst von gezielten Investitionen, sowie Jahresendeffekte.
Das organische Umsatzwachstum von 10 %2 im 4. Quartal war getragen von den Wachstumsvektoren, insbesondere von Biopharma dank erfolgreicher Ausweitung der Produkteinführungen. Der Umsatz erreichte mit 2.214 Mio € den höchsten absoluten Wert in einem Einzelquartal in der Fresenius Kabi-Unternehmensgeschichte; Währungsumrechnungseffekte, im Wesentlichen aus dem US-Dollar und dem argentinischen Peso, beeinflussten das berichtete Wachstum deutlich negativ.
Fresenius Helios
Im Geschäftsjahr 2025 erzielte Fresenius Helios aufgrund eines soliden Fallzahlenwachstums und positiver Preisentwicklung in Deutschland und Spanien ein organisches Umsatzwachstum von 7 %. Die EBIT-Marge lag mit 9,8 %1 im Rahmen des Ausblicks für das Geschäftsjahr 2025.
Im 4. Quartal 2025 verzeichnete Fresenius Helios ein sehr starkes organisches Umsatzwachstum und eine ausgezeichnete Margenverbesserung.
Das organische Umsatzwachstum lag bei 8 % bedingt durch die gestiegene Anzahl durchgeführter Behandlungen in Deutschland und Spanien sowie die positive Preisentwicklung; Umsatzanstieg währungsbereinigt um 8 % auf 3.546 Mio €.
1 Vor Sondereinflüssen
2 Organische Wachstumsrate bereinigt um Rechnungslegungseffekte im Zusammenhang mit der Hyperinflation in Argentinien
3 Wachstumsrate bereinigt um Hyperinflation in Argentinien
4 Ohne Fresenius Medical Care
5 Netto-Finanzverbindlichkeiten und EBITDA jeweils auf Basis der zu aktuellen Währungsrelationen durchschnittlichen Jahreswechselkurse gerechnet; proforma Akquisitionen/Desinvestitionen, inklusive Leasingverbindlichkeiten; inklusive Fresenius Medical Care Dividende, Netto-Finanzverbindlichkeiten adjustiert um den Bewertungseffekt der Umtauschanleihe
6 2025 Basis: 22.554 Mio € (Umsatz) und 2,87 € (Core Ergebnis je Aktie1,4)
7 2025 Basis: 8.612 Mio € (Umsatz) und 1.413 Mio € (EBIT)
8 2025 Basis: 13.550 Mio € (Umsatz) und 1.328 Mio € (EBIT)
9 Diese Kennzahl (EBIT-Marge) wird ausschließlich nachrichtlich bzw. zu Modellierungszwecken bereitgestellt Sie ist nicht Bestandteil des offiziellen Ausblicks; 2025 Basis: 2.595 Mio €

Telefonkonferenz und Audio-Webcast
Anlässlich der Veröffentlichung der Ergebnisse für das 4. Quartal und Geschäftsjahr 2025 findet am 25. Februar 2026 um 13:30 Uhr MEZ / 07:30 Uhr EST eine Telefonkonferenz bzw. ein Audio-Webcast statt. Die Telefonkonferenz können Sie live über das Internet verfolgen unter www.fresenius.de/investoren. Nach der Veranstaltung steht Ihnen die Aufzeichnung zur Verfügung.
Kontakt für Aktionärinnen und Aktionäre
Investor Relations Telefon: (06172) 608-24 87
E-Mail: ir-fre@fresenius.com

Hinweis auf Darstellungsweise der Finanzzahlen
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zurzeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts- und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren, die Verfügbarkeit finanzieller Mittel sowie unvorhergesehene Auswirkungen internationaler Konflikte. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Fresenius SE & Co. KGaA Sitz der Gesellschaft: Bad Homburg, Deutschland / Handelsregister: Amtsgericht Bad Homburg, HRB 11852
Aufsichtsratsvorsitzender: Wolfgang Kirsch
Persönlich haftende Gesellschafterin: Fresenius Management SE Sitz der Gesellschaft: Bad Homburg, Deutschland / Handelsregister: Amtsgericht Bad Homburg, HRB 11673 Vorstand: Michael Sen (Vorsitzender), Pierluigi Antonelli, Sara Hennicken, Robert Möller, Dr. Michael Moser
Aufsichtsratsvorsitzender: Wolfgang Kirsch
Der Aufsichtsrat von Fresenius hat einstimmig das Mandat des Vorstandsvorsitzenden Michael Sen (57) vorzeitig um 5 Jahre verlängert und sichert damit Kontinuität an der Konzernspitze für die weitere Umsetzung von #FutureFresenius. Der Vertrag läuft nun bis 2031.
Wolfgang Kirsch, Aufsichtsratsvorsitzender von Fresenius: „Michael Sen hat den Konzern mit #FutureFresenius in den vergangenen drei Jahren maßgeblich weiterentwickelt. Das Unternehmen ist heute innovativer und relevanter und hat damit alle Voraussetzungen, um die großen Chancen in der Gesundheitswirtschaft zu nutzen. Michael Sen und sein Team haben Fresenius auf einen langfristigen, profitablen Wachstumskurs gebracht, und davon profitieren alle Stakeholder. Diese Kontinuität wollen wir beibehalten. Der Aufsichtsrat und ich persönlich freue mich auf die weitere Zusammenarbeit in den kommenden Jahren.“
„Ich danke dem Aufsichtsrat für das Vertrauen und freue mich auf die weitere Zusammenarbeit mit allen Mitgliedern des Aufsichtsrats, meinem Vorstandsteam, unseren hervorragenden Mitarbeitenden sowie unseren Kunden, Partnern und Anteilseignern. In den vergangenen Jahren haben wir das Unternehmen innovativer gemacht und gleichzeitig auf profitables Wachstum ausgerichtet. Fresenius Seite 1/3 ist heute relevanter denn je. Diese Erfolgsgeschichte wollen wir weiter fortschreiben. In einer Zeit tiefgreifender Veränderungen – geprägt durch den rasanten Fortschritt neuer Technologien wie KI und durch eine transaktionale Weltordnung – tragen wir als weltweit führender Gesundheitskonzern noch mehr Verantwortung. Unser Ziel ist mehr denn je, eine hochwertige und verlässliche medizinische Versorgung sicherzustellen und zugleich Gesundheitssysteme effizienter und resilienter zu machen“, ergänzt Michael Sen, Vorstandsvorsitzender von Fresenius.
Dr. Christian Pawlu folgt auf Robert Möller
Außerdem beruft der Fresenius-Aufsichtsrat einstimmig zum 1. Juli 2026 Dr. med. Christian Pawlu (48) in den Fresenius-Vorstand, wo er die Geschäfte von Fresenius Helios verantwortet. Dazu zählen die beiden privaten Klinikketten Quirónsalud in Spanien sowie die Helios Kliniken in Deutschland. Damit folgt er im Vorstand auf Robert Möller (59), der künftig das Büro der Unternehmensleitung in Berlin und Brüssel aufbauen wird.
„Im Namen des Aufsichtsrats bedanke ich mich sehr bei Robert Möller für die gute Zusammenarbeit und die erfolgreiche Führung von Fresenius Helios in den vergangenen Jahren. Mit der Bildung medizinischer Cluster und dem Fokus auf Digitalisierung und exzellente Patientenversorgung sind die beiden Klinikketten in Deutschland und Spanien hervorragend positioniert. Ich begrüße es deshalb sehr, dass Robert Möller mit seiner Expertise dem Unternehmen verbunden bleibt“, sagt Wolfgang Kirsch. Er ergänzt: „Mit Christian Pawlu konnten wir einen Mediziner und Strategen mit einem breiten internationalen Netzwerk für den Konzernvorstand gewinnen. Besonders freut mich, dass wir einen hervorragenden internen Kandidaten gefunden haben, der als COO von Fresenius Helios bereits wichtige Impulse für das Klinikgeschäft gesetzt hat. Ich wünsche Herrn Pawlu einen guten Start in der neuen Rolle.“
Michael Sen (57) ist seit dem 1. Oktober 2022 Vorstandsvorsitzender von Fresenius. Zudem ist er Aufsichtsratsvorsitzender des börsennotierten Dialyse- Anbieters Fresenius Medical Care. Michael Sen kam im April 2021 zu Fresenius als Vorstandsvorsitzender von Fresenius Kabi. Vor seinem Wechsel zu Fresenius war er Mitglied des Vorstands der Siemens AG und dort für das Gesundheits- und Energiegeschäft verantwortlich. In dieser Zeit brachte er Siemens Healthineers an die Börse. Zuvor war er unter anderem Finanzvorstand beim Energiekonzern E.ON SE.
Dr. med. Christian Pawlu ist seit März 2025 Chief Operating Officer (COO) bei Helios in Deutschland, seit September 2025 COO des Unternehmensbereichs Fresenius Helios, zu dem Helios Deutschland und Quirónsalud gehören. Zuvor war er Leiter Corporate Development bei Fresenius, nachdem er im April 2021 als Leiter Corporate Development zu Fresenius Kabi nach Bad Homburg kam. Von 2022 bis 2025 war Christian Pawlu Mitglied des Aufsichtsrats der Fresenius-Tochterfirma mAbxience mit Sitz in Spanien. Davor war Christian Pawlu im Executive Committee von Sandoz, CEO eines High-Tech-Startups und Partner bei der Management Beratung McKinsey & Company.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zurzeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts- und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren, die Verfügbarkeit finanzieller Mittel sowie unvorhergesehene Auswirkungen internationaler Konflikte. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
Fresenius SE & Co. KGaA
Sitz der Gesellschaft: Bad Homburg, Deutschland / Handelsregister: Amtsgericht Bad Homburg, HRB 11852
Aufsichtsratsvorsitzender: Wolfgang Kirsch
Persönlich haftende Gesellschafterin: Fresenius Management SE
Sitz der Gesellschaft: Bad Homburg, Deutschland /Handelsregister: Amtsgericht Bad Homburg, HRB 11673 Vorstand: Michael Sen (Vorsitzender), Pierluigi Antonelli, Sara Hennicken, Robert Möller, Dr. Michael Moser
Aufsichtsratsvorsitzender: Wolfgang Kirsch
Der Aufsichtsrat von Fresenius hat einstimmig das Mandat des Vorstandsvorsitzenden Michael Sen (57) vorzeitig um 5 Jahre verlängert und sichert damit Kontinuität an der Konzernspitze für die weitere Umsetzung von #FutureFresenius. Der Vertrag läuft nun bis 2031.
Wolfgang Kirsch, Aufsichtsratsvorsitzender von Fresenius: „Michael Sen hat den Konzern mit #FutureFresenius in den vergangenen drei Jahren maßgeblich weiterentwickelt. Das Unternehmen ist heute innovativer und relevanter und hat damit alle Voraussetzungen, um die großen Chancen in der Gesundheitswirtschaft zu nutzen. Michael Sen und sein Team haben Fresenius auf einen langfristigen, profitablen Wachstumskurs gebracht, und davon profitieren alle Stakeholder. Diese Kontinuität wollen wir beibehalten. Der Aufsichtsrat und ich persönlich freue mich auf die weitere Zusammenarbeit in den kommenden Jahren.“
„Ich danke dem Aufsichtsrat für das Vertrauen und freue mich auf die weitere Zusammenarbeit mit allen Mitgliedern des Aufsichtsrats, meinem Vorstandsteam, unseren hervorragenden Mitarbeitenden sowie unseren Kunden, Partnern und Anteilseignern. In den vergangenen Jahren haben wir das Unternehmen innovativer gemacht und gleichzeitig auf profitables Wachstum ausgerichtet. Fresenius ist heute relevanter denn je. Diese Erfolgsgeschichte wollen wir weiter fortschreiben. In einer Zeit tiefgreifender Veränderungen – geprägt durch den rasanten Fortschritt neuer Technologien wie KI und durch eine transaktionale Weltordnung – tragen wir als weltweit führender Gesundheitskonzern noch mehr Verantwortung. Unser Ziel ist mehr denn je, eine hochwertige und verlässliche medizinische Versorgung sicherzustellen und zugleich Gesundheitssysteme effizienter und resilienter zu machen“, ergänzt Michael Sen, Vorstandsvorsitzender von Fresenius.
Dr. Christian Pawlu folgt auf Robert Möller
Außerdem beruft der Fresenius-Aufsichtsrat einstimmig zum 1. Juli 2026 Dr. med. Christian Pawlu (48) in den Fresenius-Vorstand, wo er die Geschäfte von Fresenius Helios verantwortet. Dazu zählen die beiden privaten Klinikketten Quirónsalud in Spanien sowie die Helios Kliniken in Deutschland. Damit folgt er im Vorstand auf Robert Möller (59), der künftig das Büro der Unternehmensleitung in Berlin und Brüssel aufbauen wird.
„Im Namen des Aufsichtsrats bedanke ich mich sehr bei Robert Möller für die gute Zusammenarbeit und die erfolgreiche Führung von Fresenius Helios in den vergangenen Jahren. Mit der Bildung medizinischer Cluster und dem Fokus auf Digitalisierung und exzellente Patientenversorgung sind die beiden Klinikketten in Deutschland und Spanien hervorragend positioniert. Ich begrüße es deshalb sehr, dass Robert Möller mit seiner Expertise dem Unternehmen verbunden bleibt“, sagt Wolfgang Kirsch. Er ergänzt: „Mit Christian Pawlu konnten wir einen Mediziner und Strategen mit einem breiten internationalen Netzwerk für den Konzernvorstand gewinnen. Besonders freut mich, dass wir einen hervorragenden internen Kandidaten gefunden haben, der als COO von Fresenius Helios bereits wichtige Impulse für das Klinikgeschäft gesetzt hat. Ich wünsche Herrn Pawlu einen guten Start in der neuen Rolle.“
Michael Sen (57) ist seit dem 1. Oktober 2022 Vorstandsvorsitzender von Fresenius. Zudem ist er Aufsichtsratsvorsitzender des börsennotierten Dialyse- Anbieters Fresenius Medical Care. Michael Sen kam im April 2021 zu Fresenius als Vorstandsvorsitzender von Fresenius Kabi. Vor seinem Wechsel zu Fresenius war er Mitglied des Vorstands der Siemens AG und dort für das Gesundheits- und Energiegeschäft verantwortlich. In dieser Zeit brachte er Siemens Healthineers an die Börse. Zuvor war er unter anderem Finanzvorstand beim Energiekonzern E.ON SE.
Dr. med. Christian Pawlu ist seit März 2025 Chief Operating Officer (COO) bei Helios in Deutschland, seit September 2025 COO des Unternehmensbereichs Fresenius Helios, zu dem Helios Deutschland und Quirónsalud gehören. Zuvor war er Leiter Corporate Development bei Fresenius, nachdem er im April 2021 als Leiter Corporate Development zu Fresenius Kabi nach Bad Homburg kam. Von 2022 bis 2025 war Christian Pawlu Mitglied des Aufsichtsrats der Fresenius-Tochterfirma mAbxience mit Sitz in Spanien. Davor war Christian Pawlu im Executive Committee von Sandoz, CEO eines High-Tech-Startups und Partner bei der Management Beratung McKinsey & Company.
Fresenius SE & Co. KGaA (Frankfurt/Xetra: FRE) ist ein weltweit tätiges Gesundheitsunternehmen mit Sitz in Bad Homburg v. d. Höhe, Deutschland. Fresenius umfasst die operativen Unternehmensbereiche Fresenius Kabi und Fresenius Helios sowie eine Unternehmensbeteiligung an Fresenius Medical Care. Fresenius Helios ist mit rund 140 Krankenhäusern und zahlreichen ambulanten Einrichtungen der führende private Krankenhausbetreiber in Deutschland und Spanien. Das Produktportfolio von Fresenius Kabi erreicht jährlich 450 Millionen Patienten und umfasst eine Reihe hochkomplexer Biopharmazeutika, klinische Ernährung, Medizintechnik sowie intravenös verabreichte generische Arzneimittel und Fluids. Fresenius wurde im Jahr 1912 vom Frankfurter Apotheker Dr. Eduard Fresenius gegründet. Nach seinem Tod übernahm Else Kröner 1952 die Firmenleitung und legte die Basis für ein Unternehmen, das heute das Ziel verfolgt, die Gesundheit der Menschen zu verbessern. Größter Anteilseigner ist die gemeinnützige Else Kröner-Fresenius-Stiftung, die sich der Förderung medizinischer Forschung und Unterstützung humanitärer Projekte verschrieben hat.
Aktuelles Videomaterial für Fernseh- oder Onlinebeiträge. Für Journalisten haben wir Videomaterial zu verschiedenen Themen rund um Fresenius zusammengestellt. Die Zusammenstellung zeigt beispielhaft zentrale Standorte und Leistungen des Unternehmens:
00:00–00:47: Unternehmenszentrale
00:48–01:00: Produktion Pharma und Infusionslösungen sowie Logistik (Fresenius Kabi)
01:01–01:52: BiopharmaProduktion und Forschung (Fresenius Kabi)
01:53–03:07: Medizinische Versorgung – Bronchoskopie, MRT, KIgestützte Diagnostik und FrühchenVersorgung (Fresenius Helios)


Michael Sen
CEO Fresenius
Fresenius hat zum dreizehnten Mal den Fresenius-Ausbildungspreis verliehen. Das Gesundheitsunternehmen ehrt jährlich Absolventinnen und Absolventen mit den besten Abschlüssen in der Berufsausbildung oder im dualen Studium. An 23 Standorten in ganz Deutschland wurden in diesem Jahr 67 Preisträgerinnen und Preisträger ausgezeichnet – so viele wie noch nie zuvor. Darunter sind auch sechs Nachwuchskräfte aus Bad Homburg und zwei aus Friedberg.
„Die hohe Qualität unserer Ausbildungsprogramme hat für uns einen hohen Stellenwert. So ermöglichen wir jungen Menschen vielfältige Chancen und stärken zugleich nachhaltig die Zukunft unseres Unternehmens“, sagt Yvonne Albert, Chief Human Resources Officer von Fresenius. „Mit unserem Ausbildungspreis wollen wir unsere Nachwuchskräfte zu Bestleistungen motivieren und ihr großartiges Engagement sichtbar machen.“
In Bad Homburg durften in diesem Jahr Julia Eichler (Industriekauffrau), Ann- Christin Kaiser (Kauffrau für Büromanagement), Marco Massanek (Kaufmann für Büromanagement), Noa Schmitt (Industriekaufmann) sowie die dual Studierenden Ronja Edelmeier (B.A. International Business Management) und Lukas Runge (B.Sc. Wirtschaftsinformatik) den Fresenius-Ausbildungspreis entgegennehmen. In Friedberg ging die Auszeichnung an Musa Yaya (Maschinen- und Anlagenführer) und Jula Nikisch (Chemielaborantin).
„Ich kann die Ausbildung bei Fresenius jedem nur weiterempfehlen“, sagt Preisträgerin Ann-Christin Kaiser, die heute als Gehaltsabrechnungs-Expertin in der HR-Abteilung arbeitet. „Vom Veranstaltungsmanagement bis zum Facility- Management: Als großer Gesundheitskonzern hat mir Fresenius in meiner Ausbildung als Kauffrau für Büromanagement unglaublich viele Einsatzmöglichkeiten geboten. Gleichzeitig war mir immer klar, wofür ich das alles tue – auch ohne direkten Patientenkontakt.“
Auch Lukas Runge hat vor allem die besondere Kombination aus Vielfalt und Sinn begeistert: „Ich habe mich für mein duales Studium ganz bewusst für ein Gesundheitsunternehmen entschieden, weil ich mit meiner Arbeit etwas bewegen wollte.“ Nach sechs Stationen im Unternehmen, die er frei wählen konnte, fand der Wirtschaftsinformatik-Student seine Berufung schließlich im Bereich Cybersecurity. „Jetzt helfe ich mit, ein Unternehmen zu schützen, das Menschen schützt.“
Aktuell bildet Fresenius bundesweit mehr als 7.000 Auszubildende und dual Studierende aus. Mit einer Ausbildungsquote von über 8 Prozent gehört der Konzern zu den größten und innovativsten Ausbildungsbetrieben in Deutschland.
Für das Ausbildungsjahr 2026, das ab August beginnt, können sich Schulabsolventinnen und -absolventen noch auf einen von über 2.500 Plätzen in mehr als 30 Ausbildungsberufen und über 25 dualen Studiengängen bundesweit bewerben.
Weitere Informationen zur Ausbildung bei Fresenius gibt es unter ausbildung.fresenius.de.
Diese Mitteilung enthält zukunftsbezogene Aussagen, die gewissen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zurzeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie zum Beispiel Veränderungen der Geschäfts-, Wirtschafts- und Wettbewerbssituation, Gesetzesänderungen, Ergebnisse klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren, die Verfügbarkeit finanzieller Mittel sowie unvorhergesehene Auswirkungen internationaler Konflikte. Fresenius übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.