Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelbehörde (EMA) hat eine positive Empfehlung für die Zulassung des Biosimilars MSB11456 von Fresenius Kabi erteilt. MSB11456 ist der erste Biosimilar-Kandidat von Tocilizumab, für den der CHMP ein positives Votum für die Behandlung mehrerer Autoimmunkrankheiten abgegeben hat. Die Zulassung ist ein wichtiger Meilenstein in der Wachstumsstrategie Vision 2026 von Fresenius Kabi.
Weitere Informationen finden Sie auf der Website von Fresenius Kabi.
Fresenius Kabi hat heute bekannt gegeben, dass der Biosimilar-Kandidat FKS518, ein Denosumab-Biosimilar-Kandidat für das US-amerikanische Referenzprodukt Prolia®*, in einer kürzlich durchgeführten klinischen Studie zur pharmakokinetischen Äquivalenz seine primären und sekundären Endpunkte erfolgreich erreicht hat. Weitere Informationen finden Sie auf der Website von Fresenius Kabi.
*Prolia® ist eine eingetragene Marke von Amgen Inc.
Fresenius Kabi hat heute die sofortige Verfügbarkeit von zwei Arzneimitteln in den USA bekannt gegeben. Das erste Produkt Ganirelix Acetate Injektion, ein generisches Medikament zur Unterstützung von Kinderwunschbehandlungen, ist Teil der Expansion des Unternehmens im Bereich der Frauengesundheit. Ganirelix Acetate Injection ist geeignet für die Hemmung des vorzeitigen Anstiegs des luteinisierenden Hormons, einer körpereigenen Substanz, die Reproduktionsprozesse wie den Eisprung auslöst. Das zweite Produkt ist Fentanylcitrat in einer Simplist®-Fertigspritze. Das Produkt ist die einzige 100 mcg pro 2 ml Darreichungsform, die auf dem US-Markt in einer vom Hersteller vorbereiteten Fertigspritze erhältlich ist.
Fresenius Kabi hat heute die Einführung in den US-Markt des zitratfreien Biosimilars Idacio®* (Adalimumab-aacf) zur Behandlung von chronischen Autoimmunerkrankungen bekannt gegeben. Idacio® (Adalimumab-aacf) ist ein Tumornekrosefaktor (TNF)-Blocker und ein Biosimilar zu Humira®** (Adalimumab). Idacio® ist die zweite Markteinführung eines Biosimilars von Fresenius Kabi in den USA und ein weiterer wichtiger Meilenstein im Rahmen der Wachstumsstrategie Vision 2026, mit der Fresenius Kabi sein Biopharma-Geschäft weltweit ausbauen will.
* Idacio® ist eine eingetragene Marke der Fresenius Kabi Deutschland GmbH in ausgewählten Ländern.
**Humira® ist eine eingetragene Marke von AbbVie, Inc.
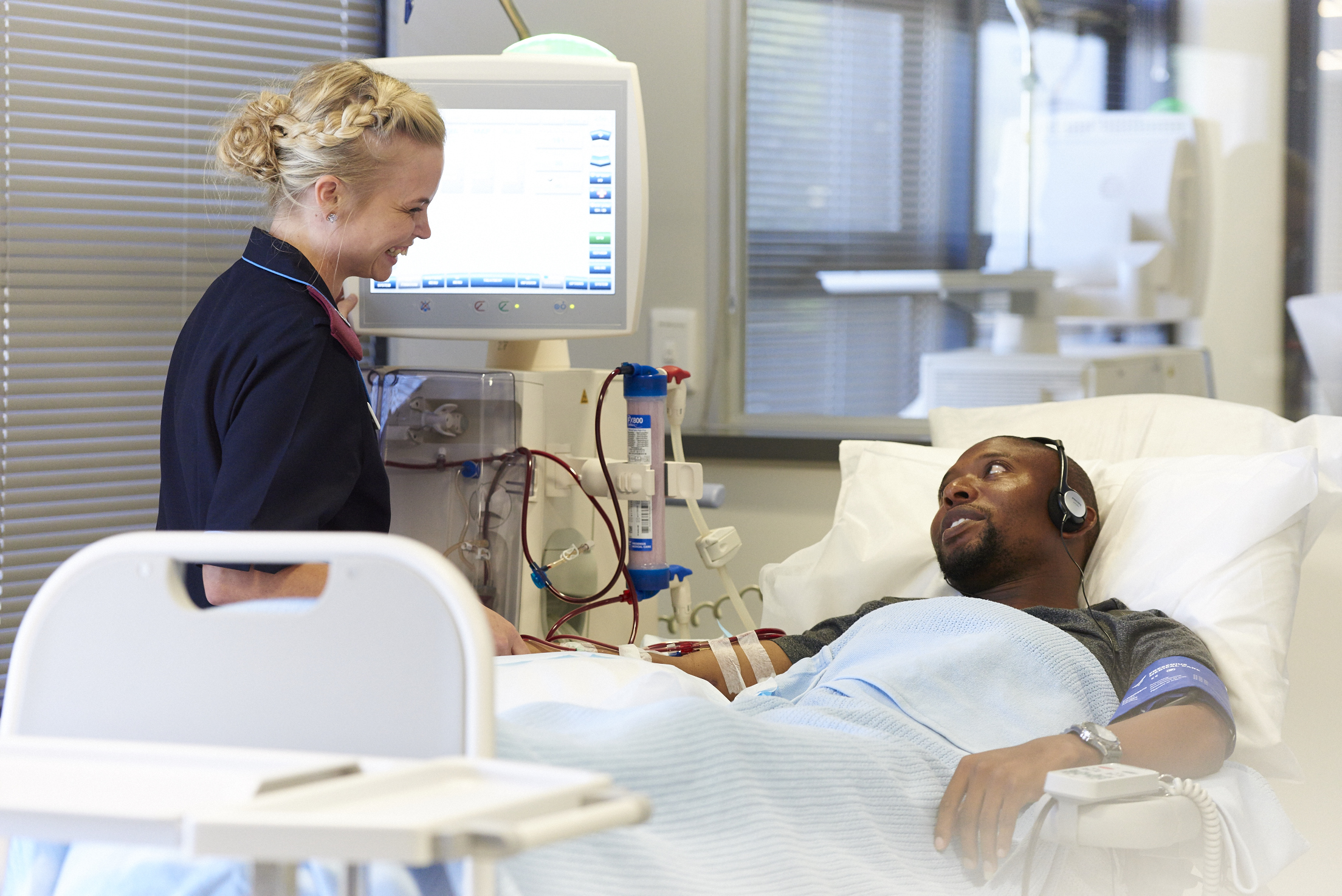
- CONVINCE-Studie vergleicht die hochdosierte Hämodiafiltration mit der Standard-Hämodialyse mit hohem Durchfluss
- Ergebnis: Sterblichkeitsrate bei Patient*innen, die mit hochvolumiger Hämodiafiltration behandelt wurden, um 23 Prozent niedriger war als bei Patient*innen, die mit der üblicherweise verwendeten Hochfluss-Hämodialyse behandelt wurden
- Es ist nun geplant, die Akzeptanz der Hämodiafiltration (HDF) zu erhöhen und als Therapie-Option für Patient*innen zugänglich zu machen
Fresenius Medical Care, der weltweit führende Anbieter von Produkten und Dienstleistungen für Menschen mit Nierenerkrankungen, hat sich an einer wegweisenden Studie beteiligt, die zeigt, dass die Sterblichkeitsrate von Patient*innen mit Nierenversagen durch den Einsatz hochdosierter Hämodiafiltration deutlich gesenkt werden kann. Die vom CONVINCE-Konsortium unter der Leitung des University Medical Center Utrecht durchgeführte internationale, randomisierte, kontrollierte Studie ist ein entscheidender Meilenstein beim Vergleich der Hochdosis-Hämodiafiltration mit der Standard-Hämodialyse mit hohem Durchfluss.
Die Studie ergab, dass die Sterblichkeitsrate bei Patient*innen, die mit Hochdosis-Hämodiafiltration behandelt wurden, um bemerkenswerte 23 Prozent niedriger war als bei Patient*innen, die mit der üblicherweise verwendeten Hochfluss-Hämodialyse behandelt wurden. Die Hämodialyse ist die am weitesten verbreitete Form der Dialyse zur Behandlung von Nierenversagen. Auch wenn sich die Behandlungstechniken im Laufe der Zeit verbessert haben, beruht die herkömmliche Hochfluss-Hämodialyse in erster Linie auf der Diffusion, um kleine Moleküle und Flüssigkeit aus dem Blut zu entfernen. Im Gegensatz dazu werden bei der Hochdosis-Hämodiafiltration sowohl Diffusions- als auch Konvektionstechniken eingesetzt, um größere Moleküle zu entfernen und den Flüssigkeitsaustausch durch Konvektion effektiv zu steuern.
Dr. Frank Maddux, Chief Global Medical Officer von Fresenius Medical Care, zeigte sich von den Ergebnissen beeindruckt: „Diese sorgfältig konzipierte und durchgeführte klinische Studie belegt zweifelsfrei die Wirksamkeit der hochvolumigen Hämodiafiltration bei einem großen Teil der Patient*innen mit Nierenversagen. Diese Ergebnisse haben das Potenzial, bedeutende Änderungen in der Standardbehandlung zu bewirken und, was am wichtigsten ist, dazu beizutragen, die Sterblichkeitsrate in dieser gefährdeten, auf eine Nierenersatztherapie angewiesenen Gruppe zu senken.“
Der Studienleiter, Professor Peter Blankestijn vom UMC Utrecht, kommentierte: „Unsere Ergebnisse belegen eindeutig den Überlebensvorteil der Hämodiafiltration gegenüber der Hämodialyse bei der Behandlung von Nierenversagen, was sich in einer bemerkenswerten Senkung der Gesamtsterblichkeit um 23 Prozent zeigt. Ich bin optimistisch, dass die Hämodiafiltration der neue Behandlungsstandard werden kann.“
Chronische Nierenerkrankungen stellen ein gravierendes globales Gesundheitsproblem dar. Weltweit sind schätzungsweise 830 Millionen Menschen betroffen, von denen fast vier Millionen auf eine Dialyse angewiesen sind. Wenn die Nieren ihre lebenswichtigen Funktionen nicht mehr erfüllen können, wird die Dialyse eingesetzt, um das Blut zu reinigen, indem Abfallprodukte entfernt werden und das Flüssigkeitsvolumen im Körper reguliert wird.
Die Studie umfasste insgesamt 1.360 Patient*innen in 61 Dialysezentren in acht europäischen Ländern, die im Median 30 Monate lang beobachtet wurden. Davon erhielten 683 Patient*innen eine hochdosierte Hämodiafiltration und 677 eine dreimal wöchentlich stattfindende Hochfluss-Hämodialyse. In der Hämodiafiltrations-Gruppe betrugt die Sterblichkeitsrate 7,1 Todesfälle pro 100 Patientenjahre im Vergleich zu 9,2 Todesfällen pro 100 Patientenjahre in der Hämodialyse-Gruppe, was einer relativen Verringerung um 23 Prozent entspricht.
Die CONVINCE-Studie leiteten Forscher des UMC Utrecht in Zusammenarbeit mit dem University College London (UCL), der Charité Universitätsmedizin Berlin, der Universität Bari, dem George Institute for Global Health, dem Imperial College London sowie den Dialyseanbietern Fresenius Medical Care, Diaverum und B. Braun Avitum.
Während die Hämodialyse in den meisten Ländern als Standardbehandlung gilt, wird die Hämodiafiltration in einigen Regionen noch nicht ausreichend genutzt und muss z.B. in Ländern wie den USA erst noch eingeführt werden. Fresenius Medical Care ist führend in der Entwicklung von Geräten, die eine Online-Flüssigkeitserzeugung ermöglichen, sowie von innovativen Techniken zur Durchführung der Hämodiafiltration.
„Fresenius Medical Care blickt auf eine lange Geschichte von Innovationen in der Nierenheilkunde zurück, die darauf abzielen, das Leben nierenkranker Patient*innen weltweit zu verbessern“, betonte Dr. Frank Maddux. „Als Pionier in der Dialyse- und Membrantechnologie planen wir, den Einsatz der Hämodiafiltration zu fördern und diese wichtige Therapieoption für unsere Patient*innen leichter zugänglich zu machen.“
Rechtliche Hinweise:
Diese Mitteilung enthält zukunftsbezogene Aussagen, die verschiedenen Risiken und Unsicherheiten unterliegen. Die zukünftigen Ergebnisse können erheblich von den zurzeit erwarteten Ergebnissen abweichen, und zwar aufgrund verschiedener Risikofaktoren und Ungewissheiten wie z.B. Veränderungen der Geschäfts-, Wirtschafts- und Wettbewerbssituation, Gesetzesänderungen, behördlichen Genehmigungen, Auswirkungen der Covid-19-Pandemie, Ergebnissen klinischer Studien, Wechselkursschwankungen, Ungewissheiten bezüglich Rechtsstreitigkeiten oder Untersuchungsverfahren und die Verfügbarkeit finanzieller Mittel. Diese und weitere Risiken und Unsicherheiten sind im Detail in den Berichten der Fresenius Medical Care AG & Co. KGaA beschrieben, die bei der U.S.-amerikanischen Börsenaufsicht (U.S. Securities and Exchange Commission) eingereicht werden. Fresenius Medical Care übernimmt keinerlei Verantwortung, die in dieser Mitteilung enthaltenen zukunftsbezogenen Aussagen zu aktualisieren.
__________
Hinweise für die Redaktion:
Haftungsausschluss: Die Informationen in diesem Dokument werden in der vorliegenden Form bereitgestellt, und es wird keine Garantie oder Gewährleistung dafür übernommen, dass die Informationen für einen bestimmten Zweck geeignet sind. Der Nutzer verwendet die Informationen auf eigenes Risiko und eigene Haftung. Die in diesem Dokument zum Ausdruck gebrachten Meinungen sind ausschließlich die der Autoren und spiegeln in keiner Weise die Meinung der Europäischen Kommission wider.
Die CONVINCE-Studie wurde ausschließlich von der Europäischen Kommission Forschung & Innovation, Horizont 2020, Aufruf H2020-SC1-2016-2017 unter dem Thema SC1-PM-10-2017 unterstützt: Vergleich der Wirksamkeit bestehender Gesundheitsmaßnahmen in der erwachsenen Bevölkerung (Zuschuss Nr. 754803).
Fresenius Kabi erweitert sein Portfolio im Bereich der Intensivmedizin mit der Einführung von Vasopressin Injektion, USP, einem generischen Äquivalent zu Vasostrict® in den USA.
Fresenius Kabi Vasopressin ist zugelassen zur Erhöhung des Blutdrucks bei Erwachsenen mit gefäßerweiterndem Schock, die trotz Flüssigkeitszufuhr und Katecholaminen hypoton bleiben.
* Vasostrict® ist eine eingetragene Marke von Par Pharmaceutical.
Fresenius Kabi‘s Biosimilar Stimufend® (Pegfilgrastim-fpgk) ist ab sofort in den USA erhältlich. Die US-amerikanische Gesundheitsbehörde FDA hat Stimufend® im September 2022 für die Anwendung bei Patienten mit nicht-myeloischen Malignomen zugelassen, die mit myelosuppressiven Krebsmedikamenten behandelt werden und eine klinisch signifikante Häufigkeit von febrilen Neutropenien aufweisen. Es ist die erste Markteinführung eines Biosimilars von Fresenius Kabi in den USA. Die Erweiterung des globalen Biosimilar-Portfolios mit Fokus auf Onkologie und Immunologie ist ein wichtiger Meilenstein der Wachstumsstrategie Vision 2026 des Unternehmens.
* Stimufend® (Pegfilgrastim-fpgk) ist eine eingetragene Marke der Fresenius Kabi Deutschland GmbH in ausgewählten Ländern. Stimufend ist ein Pegfilgrastim-Biosimilar von Neulasta®, eine eingetragene Marke von Amgen Inc.
Das innovative Ivenix-Infusionssystem von Fresenius Kabi ist von KLAS Research in einem ersten Leistungsbericht („Performance Insights First Look“) ausgezeichnet worden. Basis sind sehr positive Kundenerfahrungen von US-Gesundheitseinrichtungen mit dem Ivenix-Infusionssystem. Ivenix wurde 2022 von Fresenius Kabi übernommen und bietet ein technologisch fortschrittliches Infusionssystem mit großvolumiger Pumpe, Infusionsmanagement, Softwarewerkzeugen, Programmen und Analysen, um die Pflegekräfte bestmöglich zu informieren, die Effizienz zu steigern, infusionsbedingte Fehler zu reduzieren und die Gesamtbetriebskosten zu senken.
Fresenius Kabi erweitert sein Portfolio im Bereich der Intensivmedizin mit der Einführung von Lacosamid Injektion, USP, einem generischen Äquivalent zu VIMPAT® in den USA.
Fresenius Kabi Lacosamid Injektion, USP ist eine zugelassene Behandlungsoption für partiell auftretende Anfälle bei Patienten ab 17 Jahren und ist ab heute in den USA erhältlich.
* VIMPAT® ist eine eingetragene Marke von UCB, Inc.
Die US-amerikanische Gesundheitsbehörde FDA hat das Biosimilar Idacio® von Fresenius Kabi, eine zitratfreie Formulierung von Adalimumab zur Behandlung von chronischen Autoimmunerkrankungen, für alle zulässigen Indikationen des Referenzprodukts Humira®** zugelassen.
Mit Idacio erweitert Fresenius Kabi sein Portfolio für Biosimilars mit Schwerpunkt auf Immunologie und Onkologie in den USA. Idacio® ist das zweite zugelassene Biosimilar von Fresenius Kabi in den USA und wird ab Juli 2023 gemäß der Patentvereinbarung mit Abbvie auf den Markt kommen.
* Idacio® ist eine eingetragene Marke der Fresenius Kabi Deutschland GmbH in ausgewählten Ländern.
**Humira® ist eine eingetragene Marke von AbbVie, Inc.
Seitennummerierung
- Vorherige Seite
- Seite 5
- Nächste Seite



